Presentación de Gateway, un ensayo clínico para la enfermedad de Wilson
Presentamos GATEWAY, un ensayo clínico para la enfermedad de Wilson
La enfermedad de Wilson es un trastorno genético raro que provoca la acumulación de un exceso de cobre en el organismo, particularmente en el hígado y el cerebro. La causa de la enfermedad es una mutación en un gen llamado ATP7B.
Si la enfermedad de Wilson no se diagnostica en sus etapas tempranas y no se trata adecuadamente, la acumulación de cobre puede causar daños serios en los órganos y provocar una discapacidad grave y posiblemente la muerte. Esto significa que el diagnóstico temprano y el tratamiento oportuno son muy importantes.
Aunque actualmente hay tratamientos médicos disponibles para la enfermedad de Wilson, los pacientes necesitan tomarlos de por vida y la respuesta terapéutica no es óptima en algunos de ellos; por lo tanto, es deseable que se desarrollen nuevas opciones terapéuticas.
VTX-801 es un nuevo tratamiento de terapia génica para la enfermedad de Wilson que actualmente se está investigando en el estudio GATEWAY. En el ensayo clínico GATEWAY se explorará la seguridad, la eficacia y la duración del efecto de este tratamiento.
Información del ensayo clínicos
¿Qué es el ensayo clínico GATEWAY?
El nombre "GaTeWay" corresponde a las siglas en inglés de Terapia Génica para la enfermedad de Wilson.
GATEWAY es un ensayo clínico (también conocido como "estudio de investigación clínica") de terapia génica que se lleva a cabo en pacientes con enfermedad de Wilson. Su objetivo es evaluar si el fármaco del estudio, llamado VTX-801, es seguro y cuál es la dosis más adecuada que puede restaurar de forma duradera la eliminación del exceso de cobre por la vía natural.
¿Quién lleva a cabo este ensayo clínico?
El patrocinador del ensayo clínico es Vivet Therapeutics, una empresa de biotecnología con sede en Francia, que está desarrollando terapias génicas para trastornos hepáticos raros. Para este ensayo clínico de fase 1/2, Vivet está colaborando con Pfizer para el suministro clínico de VTX-801, que es el tratamiento de propiedad exclusiva de Vivet para la enfermedad de Wilson.
¿Qué deben esperar los participantes del ensayo?
Los pacientes recibirán una dosis única de VTX-801 en un entorno hospitalario. Luego, los pacientes irán al centro de estudio que les corresponda en visitas planificadas a lo largo del siguiente año para que el equipo del estudio pueda valorar cómo les está yendo. Estas visitas tendrán lugar con mayor frecuencia en la primera parte del ensayo (el primer año) y la cantidad de visitas será menor a partir de entonces. El estudio continuará durante 4 años después del periodo inicial del ensayo de 1 año, lo que será una parte fundamental para comprender qué tan bien funciona el VTX-801 a lo largo del tiempo.
¿En qué consiste el tratamiento VTX-801?
La terapia génica que se está estudiando en este ensayo, VTX-801, contiene una versión correctiva del gen ATP7B, el cual no funciona correctamente en pacientes afectados por la enfermedad de Wilson.
La versión correctiva del gen se introduce en un vector, que es un virus modificado mediante ingeniería genética llamado virus adenoasociado (adeno-associated virus, AAV), para que lleve el gen a las células del hígado sin causar una infección. El tratamiento se administra en forma de una sola infusión intravenosa. Pfizer fabrica el suministro clínico de VTX-801 en nombre de Vivet Therapeutics, en una planta de producción ubicada en los Estados Unidos.
Vea el video para conocer más acerca de cómo la terapia génica va dirigida a corregir la causa de la enfermedad de Wilson (material educativo de la Sociedad Estadounidense de Terapia Génica y Celular [American Society of Gene and Cell Therapy])
Verifique si es elegible para participar
Si respondió "sí" a estas tres preguntas, podría ser elegible para participar en GATEWAY.
Si está interesado en participar, comuníquese con el centro clínico participante más cercano (consulte los mapas y los datos de contacto) para ver si cumple con los demás criterios de inclusión.
¿Dónde se está llevando a cabo el ensayo GATEWAY?
Como se indica a continuación, el ensayo se llevará a cabo en varios centros clínicos ubicados en los Estados Unidos, el Reino Unido, Alemania y Dinamarca. El mapa y los datos de contacto se actualizarán en cuanto se reciba la aprobación de las autoridades reguladoras locales para comenzar el ensayo en cada nuevo centro.
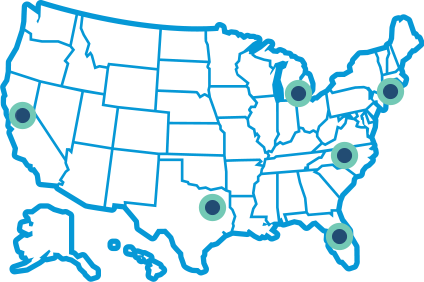
Póngase en contacto con un centro en los Estados Unidos
University of California Davis
Dr. Valentina Medici
2000 Stockton Blvd
Sacramento, CA 95817
Sandeep Dhaliwal
(916) 734‐8696
University of Michigan Health System
Dr. Frederick Askari
1500 East Medical Center Dr. UH South F5161
Ann Arbor, MI 48109
Ashley Page
(734) 998-9966
Yale University School of Medicine
Dr. Michael Schilsky
310 Cedar Street
FMB 18
New Haven, CT 06520
Daksshi Hettiarachchi
(203) 737-5037
daksshi.hettiarachchi@yale.edu
Advent Health
Dr. Regino Gonzalez-Peralta
615 East Princeton Street
Orlando, Florida
Pamela Hedrick
(407) 303-5600 x112-3143
Pamela.Hedrick@AdventHealth.com
University of Texas Southwestern Medical Center
Dr. William Lee
5929 Harry Hines Boulevard
POB 1
Dallas, Texas
Amy Pugh
(214) 648-4412
Wake Forest School of Medicine
Dr. Sean Rudnick
Medical Center Boulevard
Winston-Salem, NC 27157
Dee Faust
+1 336.713.1442
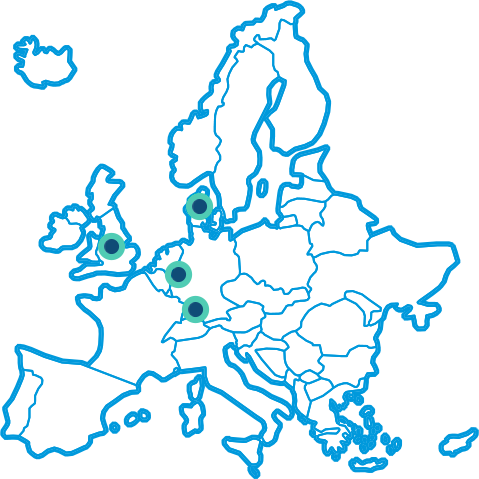
Póngase en contacto con un centro en Europa
Aarhus Universitetshospital
Dr Thomas Damgaard Sandahl
Palle Juul-Jensens Boulevard 99
8200 Aarhus
Danmark
+45 5129 3791
Royal Surrey County Hospital
Pr. Aftab Ala
Egerton Road
Guilford,
Surrey GU2 7XX
United Kingdom
Pr. Aftab Ala
(+44) 1483 571 122
Universitätsklinikum Tübingen (UKT)
Pr. Ulrich Lauer
Otfried-Müller-Str. 10
72076 Tübingen
Deutschland
Prof. Ulrich Lauer
+49 7071-2983190
ulrich.lauer@med.uni-tuebingen.de
University Hospital Essen
Hufelandstrasse 55
45147 Essen
Deutschland
Prof. Hartmut Schmidt
+49 201 5990015
Preguntas frecuentes
-
¿Tendrá algún costo participar en el ensayo?
Es posible que el Patrocinador cubra los gastos de viaje y las pruebas relacionadas con el estudio.
-
¿Todos los que participen en el ensayo clínico GATEWAY recibirán la terapia génica?
Sí. No hay un grupo de placebo en este estudio, de modo que todos los participantes recibirán la terapia génica experimental VTX-801.
-
¿Qué es la terapia génica?
El método que usamos para desarrollar nuestra terapia génica consiste en introducir un gen correctivo en las células del hígado para restaurar una función hepática adecuada y eliminar el exceso de cobre.
Para que un gen entre a una célula, debe introducirse en un vehículo de administración, lo que también se conoce como "vector".
Los virus funcionan bien como vectores porque pueden entrar fácilmente a nuestras células. Mediante la ingeniería genética, los científicos pueden diseñar versiones apropiadas de virus y convertirlos en vectores para este propósito. Estos son inofensivos y no causan enfermedades cuando se usan en personas. Para lograr esto, los científicos reemplazan el ADN que está presente naturalmente en el virus con el gen que se usará para tratar la enfermedad.
Para obtener más información sobre la terapia génica para la enfermedad de Wilson, consulte el material educativo de la Sociedad Estadounidense de Terapia Génica y Celular [American Society of Gene and Cell Therapy]
-
¿Qué involucra la participación en el ensayo clínico GATEWAY?
La mayoría de las visitas del estudio están previstas durante el primer año, y la duración total del estudio es de 5 años. Durante el primer año, y con el objetivo de facilitarle la tarea, algunas de las visitas para recolectar muestras de sangre y orina, están previstas en su domicilio en lugar del hospital.
-
¿Cuántos pacientes pueden participar en el ensayo clínico?
Estamos buscando a aproximadamente 16 pacientes para que se inscriban en el estudio GATEWAY.
-
¿Quién decide quién puede participar en el ensayo clínico?
Los criterios específicos de inclusión se encuentran descritos en el protocolo del estudio GATEWAY. Este es un documento que elabora el Patrocinador y que luego recibe el acuerdo de expertos en enfermedad de Wilson y de las autoridades reguladoras competentes (incluida la Administración de Alimentos y Medicamentos [Food and Drug Administration, FDA]). Con base en estos criterios, el comité de inclusión del estudio, compuesto por investigadores y co-investigadores, decide quién puede participar en el estudio.
-
¿Por qué solo pueden inscribirse pacientes adultos con enfermedad de Wilson estable en el estudio GATEWAY?
En este primer ensayo clínico solo podrán participar adultos con enfermedad de Wilson estable; sin embargo, cuando se hayan recabado suficientes datos en GATEWAY, es posible que se organicen otros ensayos para estudiar a otras poblaciones de pacientes.
-
¿Está disponible el producto de terapia génica VTX-801 fuera del contexto de GATEWAY?
Actualmente, dado que VTX-801 es un tratamiento en investigación, solo está disponible para pacientes inscritos en GATEWAY.
VTX-801 no estará disponible fuera del contexto de ensayos clínicos hasta que se haya completado su desarrollo y las autoridades competentes hayan decidido si se puede aprobar para su comercialización. Por lo general, todo el proceso lleva algunos años desde que inicia el primer ensayo clínico.
-
¿Dónde se fabrica VTX-801?
Pfizer fabrica el suministro clínico de VTX-801 en nombre de Vivet Therapeutics, en una planta de producción ubicada en los Estados Unidos.
Contacto: info@vivet-therapeutics.com
Sitio web diseñado por Boston Web Partners









